В России в 2018 году рост промышленного производства составил 2,9%
https://ria.ru/20190123/1549782823.html
В России в 2018 году рост промышленного производства составил 2,9%
В России в 2018 году рост промышленного производства составил 2,9% — РИА Новости, 03.03.2020
В России в 2018 году рост промышленного производства составил 2,9%
Рост промышленного производства в РФ по итогам 2018 года ускорился до 2,9% с 2,1% годом ранее, но оказался чуть ниже прогноза Минэкономразвития в 3%, сообщает… РИА Новости, 03.03.2020
2019-01-23T16:30
2019-01-23T16:30
2020-03-03T13:27
экономика
россия
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/sharing/article/1549782823.jpg?1583231278
МОСКВА, 23 янв — РИА Новости. Рост промышленного производства в РФ по итогам 2018 года ускорился до 2,9% с 2,1% годом ранее, но оказался чуть ниже прогноза Минэкономразвития в 3%, сообщает Росстат. В декабре промышленное производство замедлило рост в годовом выражении до 2% с ноябрьских 2,4%. В месячном выражении рост промпроизводства в декабре составил 7% против снижения на 0,2% в ноябре. С исключением сезонного и календарного факторов в декабре наблюдался рост на 0,1%.Наибольший рост производства в декабре (на 6,3% в годовом выражении) был зафиксирован в добыче полезных ископаемых. Рост в обработке в декабре был нулевым, в водоснабжении, водоотведении и ликвидации отходов — 3,8%, обеспечение электрической энергией, газом и паром выросло на 4,5%.По итогам 2017 года промпроизводство в РФ, согласно данным Росстата, выросло на 2,1%.
В декабре промышленное производство замедлило рост в годовом выражении до 2% с ноябрьских 2,4%. В месячном выражении рост промпроизводства в декабре составил 7% против снижения на 0,2% в ноябре. С исключением сезонного и календарного факторов в декабре наблюдался рост на 0,1%.Наибольший рост производства в декабре (на 6,3% в годовом выражении) был зафиксирован в добыче полезных ископаемых. Рост в обработке в декабре был нулевым, в водоснабжении, водоотведении и ликвидации отходов — 3,8%, обеспечение электрической энергией, газом и паром выросло на 4,5%.По итогам 2017 года промпроизводство в РФ, согласно данным Росстата, выросло на 2,1%.
https://ria.ru/20190111/1549156725.html
россия
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
экономика, россия
Экономика, Россия
МОСКВА, 23 янв — РИА Новости. Рост промышленного производства в РФ по итогам 2018 года ускорился до 2,9% с 2,1% годом ранее, но оказался чуть ниже прогноза Минэкономразвития в 3%, сообщает Росстат.
В декабре промышленное производство замедлило рост в годовом выражении до 2% с ноябрьских 2,4%. В месячном выражении рост промпроизводства в декабре составил 7% против снижения на 0,2% в ноябре. С исключением сезонного и календарного факторов в декабре наблюдался рост на 0,1%.
Наибольший рост производства в декабре (на 6,3% в годовом выражении) был зафиксирован в добыче полезных ископаемых. Рост в обработке в декабре был нулевым, в водоснабжении, водоотведении и ликвидации отходов — 3,8%, обеспечение электрической энергией, газом и паром выросло на 4,5%.
По итогам 2017 года промпроизводство в РФ, согласно данным Росстата, выросло на 2,1%.
Санкции придали ускорение: Всемирный банк признал рост экономики России
11 января 2019, 08:00
Промышленное производство за 9 месяцев 2018 года выросло в 62 регионах | Регионы России
РИА Рейтинг – 27 ноя. В промышленном секторе в последнее время сохраняется позитивная динамика, хотя темпы роста немного замедляются. По итогам девяти месяцев 2018 года индекс промышленного производства в РФ составил 103,0%, что несколько ниже, чем за аналогичный период 2017 года (103,3%). При этом региональном разрезе ситуация отличается неоднородностью – в ряде регионов темпы роста существенно опережают общероссийский уровень, а в ряде напротив зафиксирован спад.
По итогам девяти месяцев 2018 года индекс промышленного производства в РФ составил 103,0%, что несколько ниже, чем за аналогичный период 2017 года (103,3%). При этом региональном разрезе ситуация отличается неоднородностью – в ряде регионов темпы роста существенно опережают общероссийский уровень, а в ряде напротив зафиксирован спад.
Результаты исследования РИА Новости свидетельствуют, что значение индекса промышленного производства изменяется в очень широком диапазоне от 119,8% в Астраханской области до 93,3% в Карачаево-Черкесской Республике. Промышленное производство в январе-сентябре 2018 года выросло в 62 субъектах РФ, в одном не изменилось и в 22 снизилось.
В 5 субъектах РФ промышленное производство выросло более чем на 10%
Из 62 регионов, где промышленное производство выросло, в пяти темпы роста превысили 10%. В группу лидеров входят Астраханская область, Республика Алтай, Тамбовская область, Ямало-Ненецкий автономный округ и г. Севастополь.
Севастополь.
Высокие темпы роста промышленного производства в Астраханской области (+19,8%) в основном обусловлены увеличением производства в сфере добычи полезных ископаемых. В прошлом году здесь было запущено в эксплуатацию месторождение нефти им. Филановского. Индекс производства по виду деятельности добыча полезных ископаемых в регионе составил 126,6%. Кроме того, на 3,3% выросло производство по виду деятельности «Обрабатывающие производства».
В Республике Алтай довольно существенно выросло производство по трем видам деятельности «Добыча полезных ископаемых» (+26,4%), «Обрабатывающие производства» (+12,2%) и «Обеспечение электрической энергией, газом и паром; кондиционирование воздуха»(+17,6%).
Наибольший вклад в высокие темпы роста промышленного производства в Тамбовской области внесла обрабатывающая сфера. Индекс производства по данному виду деятельности в области по итогам января-сентября 2018 года составил 118,9%.
В Ямало-Ненецком автономном округе промышленное производство увеличилось по сравнению с январем-сентябрем 2017 года на 14,9%, что было обусловлено ростом в сфере добычи полезных ископаемых. В текущем году в регионе быстрыми темпами растет добыча газа за счет увеличения спроса на внешнем и внутреннем рынках.
В текущем году в регионе быстрыми темпами растет добыча газа за счет увеличения спроса на внешнем и внутреннем рынках.
В Севастополе, который занимает пятое место по темпам роста промышленного производства в январе-сентябре 2018 года, позитивная динамика зафиксирована в обрабатывающем и электроэнергетическом секторе. Индекс производств по виду деятельности «Обрабатывающие производства» составил 106,4%, а по виду деятельности «Обеспечение электрической энергией, газом и паром; кондиционирование воздуха» 115,6%.
Наиболее существенно промышленное производство снизилось в Ненецком автономном округе, Республике Северная Осетия – Алания и в Карачаево-Черкесской Республике. В Ненецком автономном округе и Карачаево-Черкесской Республике снизилось производство в сфере добычи полезны ископаемых и в обрабатывающем секторе, при этом в сфере электроэнергетики зафиксирована позитивная динамика. В Ненецком АО промышленное производство снижается из-за существенного сокращения добычи нефти. В свою очередь в Карачаево-Черкесской Республике негативная динамика обусловлена падением производства на автомобилестроительном предприятии «Дервэйс».
В свою очередь в Карачаево-Черкесской Республике негативная динамика обусловлена падением производства на автомобилестроительном предприятии «Дервэйс».
Снижение общего производства в Республике Северная Осетия – Алания обусловлено спадом в обрабатывающем и электроэнергетическом секторах. Однако производство в сфере добычи полезных ископаемых в Республике по итогам 9 месяцев 2018 года увеличилось на 6,9%. При этом отметим, что в четвертом квартале из-за пожара на заводе «Электроцинк» и остановки предприятия динамика производства в обрабатывающем секторе республики может еще больше ухудшиться.
Индекс промышленного производства вырос по сравнению с январем-сентябрем 2017 года только в 33 регионах.
Как уже было отмечено индекс промышленного производства по стране в целом по итогам января-сентября 2018 года снизился по сравнению с аналогичным периодом 2017 года на 0,3 процентного пункта. Позитивная динамика показателя зафиксирована только в 33 регионах, а 52 субъектах РФ индекс промышленного производства снизился. Наиболее существенно, более чем на 20 процентных пункта, индекс промышленного производства снизился по сравнению с итогами девяти месяцев 2017 года в Архангельской области, Республике Дагестан и в Еврейской автономной области. При этом в данных сохранилась позитивная динамика объемов промышленного производства. В Архангельской области индекс промышленного производства в январе-сентябре 2018 года составил 104,1%, в Республике Дагестан 102,5%, в Еврейской автономной области 101,1%.
Наиболее существенно, более чем на 20 процентных пункта, индекс промышленного производства снизился по сравнению с итогами девяти месяцев 2017 года в Архангельской области, Республике Дагестан и в Еврейской автономной области. При этом в данных сохранилась позитивная динамика объемов промышленного производства. В Архангельской области индекс промышленного производства в январе-сентябре 2018 года составил 104,1%, в Республике Дагестан 102,5%, в Еврейской автономной области 101,1%.
Более чем на 10 процентных пунктов индекс промышленного производства вырос в четырех регионах: в г. Севастополь на 14,6 п.п. до 114,1%, в Республике Алтай на 11,9 п.п. до 117,4% в Республика Бурятия на 11,6 п.п. до 103,2% и в г. Москва на 10,2% до 109,6%.
Эксперты РИА Рейтинг полагают, что до конца года темпы роста промышленного производства будут колебаться в пределах 2-3%. В целом по итогам года рост промышленного производства составит около 2,5%.
РИА Рейтинг – это универсальное рейтинговое агентство медиагруппы МИА «Россия сегодня» , специализирующееся на оценке социально-экономического положения регионов РФ, экономического состояния компаний, банков, отраслей экономики, стран. Основными направлениями деятельности агентства являются: создание рейтингов регионов РФ, банков, предприятий, муниципальных образований, страховых компаний, ценных бумаг, другим экономических объектов; комплексные экономические исследования в финансовом, корпоративном и государственном секторах.
Основными направлениями деятельности агентства являются: создание рейтингов регионов РФ, банков, предприятий, муниципальных образований, страховых компаний, ценных бумаг, другим экономических объектов; комплексные экономические исследования в финансовом, корпоративном и государственном секторах.
МИА «Россия сегодня» – международная медиагруппа, миссией которой является оперативное, взвешенное и объективное освещение событий в мире, информирование аудитории о различных взглядах на ключевые события. РИА Рейтинг в составе МИА «Россия сегодня» входит в линейку информационных ресурсов агентства, включающих также: РИА Новости, Р-Спорт, 
2018 Статистика | www.oica.net
www.oica.net > Статистика производства > Статистика за 2018 год
| Страна/регион | Легковые автомобили | Коммерческие автомобили | Итого | % изменения | |
|---|---|---|---|---|---|
| Аргентина | 208573 | 258076 | 466649 | -1,4 | |
| Австрия | 144500 | 20400 | 164900 | 69.7 | |
| Бельгия | 265958 | 42535 | 308493 | -18,2 | |
| Бразилия | 2386758 | 493051 | 2879809 | 5,2 | |
| Канада | 655896 | 1364944 | 2020840 | -7,9 | |
| Китай | 23529423 | 4279773 | 27809196 | -4,2 | |
| Колумбия | 69000 | 3800 | 72800 | -5,5 | |
| Чехия | 1345041 | 0 | 1345041 | 3 | |
| Египет | 19500 | 52100 | 71600 | 95 | |
| Финляндия | 112104 | 0 | 112104 | 3 | |
| Франция | 1763000 | 507000 | 2270000 | 2,0 | |
| Германия | 5120409 | 0 | 5120409 | -9,3 | |
| Венгрия | 430988 | 0 | 430988 | 3,0 | |
| Индия | 1109871 | 5174645 | 8,0 | ||
| Индонезия | 1055774 | 287940 | 1343714 | 10,3 | |
| Иран | 1027313 | 68213 | 1095526 | -40 | |
| Италия | 670932 | 389136 | 1060068 | -7,2 | |
| Япония | 8358220 | 1370308 | 9728528 | 0,4 | |
| Малайзия | 522000 | 42800 | 564800 | 12,2 | |
| Марокко | 368601 | 33484 | 402085 | 17,6 | |
| Мексика | 1575808 | 2524717 | 4100525 | 0,1 | |
| Польша | 451600 | 208046 | 659646 | -4,4 | |
| Португалия | 234151 | 60215 | 294366 | 67,7 | |
| Румыния | 476769 | 0 | 476769 | 31,1 | |
| Россия | 1563572 | 204102 | 1767674 | 13,9 | |
| Сербия | 56303 | 146 | 56449 | -28,5 | |
| Словакия | 10 | 0 | 10 | 5,6 | |
| Словения | 209378 | 0 | 209378 | 10,2 | |
| Южная Африка | 321097 | 289757 | 610854 | 3,5 | |
| Южная Корея | 3661730 | 367104 | 4028834 | -2,1 | |
| Испания | 2267396 | 552169 | 2819565 | -1,0 | |
| Тайвань | 1 | 63189 | 253241 | -13,1 | |
| Таиланд | 877015 | 1290679 | 2167694 | 9,0 | |
| Турция | 1026461 | 523689 | 1550150 | -8,6 | |
| Украина | 5660 | 963 | 6623 | -22,9 | |
| Великобритания | 1519440 | 84888 | 1604328 | -8,3 | |
| США | 2795971 | 8518734 | 11314705 | 1. 1 1 | |
| Узбекистан | 220667 | 0 | 220667 | 57,3 | |
| Прочие | 341554 | 152230 | 493784 | ||
| Всего | 70498388 | 25136912 | 95634593 | -1,1 |
World Moth Artain Production
/по стране/региону
по стране/региону и типа
/Пассажирские автомобили
/Легкие Коммерческие транспортные средства 0003
/ тяжелые грузовики
/ автобусы
Производство конопли и Закон о фермерских хозяйствах 2018 г. — 25.07.2019
Свидетельские показания Эми Абернети, доктора медицины, первого заместителя комиссара, Управление комиссара по пищевым продуктам и лекарствам Администрация, Министерство здравоохранения и социальных служб
перед Комитетом Сената по сельскому хозяйству, питанию и лесному хозяйству
25 июля 2019 г.
Введение
Доброе утро, председатель Робертс, высокопоставленный член Стабеноу и члены комитета. Я доктор Эми Абернети, первый заместитель комиссара Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA или Агентство), которое является частью Министерства здравоохранения и социальных служб США (HHS). Спасибо за возможность выступить перед вами сегодня, чтобы обсудить роль FDA в регулировании продуктов из конопли. Я также рад выступить с Грегом Ибахом из Министерства сельского хозяйства США (USDA) и Александрой Данн из Агентства по охране окружающей среды (EPA). FDA ежедневно сотрудничает с Министерством сельского хозяйства США и Агентством по охране окружающей среды в рамках программ Агентства, чтобы обеспечить координацию между федеральным правительством.
Во-первых, я хотел бы поблагодарить этот комитет за прямое сохранение полномочий FDA в отношении продуктов из конопли в Законе об улучшении сельского хозяйства 2018 года (Законопроект о фермерских хозяйствах 2018 года, PL 115-334). Мы признаем значительный потенциал конопли для фермеров и сельскохозяйственного сектора нашей страны. Подход FDA к каннабису и продуктам, полученным из каннабиса, включая продукты из конопли, заключается в том, чтобы относиться к этим продуктам так же, как и к любым другим. FDA стремится продвигать продукты из конопли с помощью существующих регуляторных путей Агентства, и мы дополнительно изучаем, будет ли уместно сделать дополнительные регуляторные пути доступными для продуктов из конопли, таких как содержащие каннабидиол (CBD). FDA считает, что такой подход защищает пациентов и общественное здравоохранение, способствует инновациям в области безопасных и подходящих продуктов и повышает доверие потребителей.
Мы признаем значительный потенциал конопли для фермеров и сельскохозяйственного сектора нашей страны. Подход FDA к каннабису и продуктам, полученным из каннабиса, включая продукты из конопли, заключается в том, чтобы относиться к этим продуктам так же, как и к любым другим. FDA стремится продвигать продукты из конопли с помощью существующих регуляторных путей Агентства, и мы дополнительно изучаем, будет ли уместно сделать дополнительные регуляторные пути доступными для продуктов из конопли, таких как содержащие каннабидиол (CBD). FDA считает, что такой подход защищает пациентов и общественное здравоохранение, способствует инновациям в области безопасных и подходящих продуктов и повышает доверие потребителей.
Текущее состояние нормативно-правовой базы
В декабре 2018 года был подписан Закон о фермерских хозяйствах 2018 года. Он удалил коноплю, определяемую как каннабис ( Cannabis sativa L. ) и производные каннабиса с чрезвычайно низкими концентрациями психоактивного соединения дельта-9-тетрагидроканнабинола (ТГК) (не более 0,3 процента ТГК в пересчете на сухую массу), из определение марихуаны в Законе о контролируемых веществах (CSA).
Закон о фермерских хозяйствах 2018 года явно сохранил полномочия FDA в отношении продуктов из конопли. Следовательно, продукты из конопли должны соответствовать всем применимым требованиям и стандартам FDA, как и любой другой продукт, регулируемый FDA. Например, существующие полномочия FDA в отношении пищевых продуктов, пищевых добавок, лекарств для людей и животных, а также косметики применяются к продуктам из конопли в той мере, в какой такие продукты из конопли подпадают под эти категории. Эти гарантии помогают гарантировать, что американцы имеют доступ к безопасным и точно маркированным продуктам из конопли, а в случае с лекарствами пациенты могут полагаться на эффективность этих продуктов.
В конце 2018 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) продвинуло три пищевых продукта, полученных из семян конопли, в рамках процесса Агентства, признанного безопасным (GRAS). 1 Семена конопли естественным образом не содержат каннабидиол (КБД) или ТГК, которые представляют собой каннабиноидные соединения, которые содержатся в других частях растения каннабис. Продукты из семян конопли — очищенные семена конопли, белковый порошок из семян конопли и масло из семян конопли — могут быть легально использованы в продовольственном снабжении США. Любые пищевые продукты, изготовленные с использованием этих ингредиентов из семян конопли, подпадают под те же требования FDA, что и любые другие продукты питания, например, требования, касающиеся маркировки ингредиентов и пищевой ценности, а также Закон о модернизации безопасности пищевых продуктов, ориентированный на риск и профилактику (PL 111-353). ) гарантии. 2
Продукты из семян конопли — очищенные семена конопли, белковый порошок из семян конопли и масло из семян конопли — могут быть легально использованы в продовольственном снабжении США. Любые пищевые продукты, изготовленные с использованием этих ингредиентов из семян конопли, подпадают под те же требования FDA, что и любые другие продукты питания, например, требования, касающиеся маркировки ингредиентов и пищевой ценности, а также Закон о модернизации безопасности пищевых продуктов, ориентированный на риск и профилактику (PL 111-353). ) гарантии. 2
Нынешнее положение дел в сфере регулирования является более сложным, когда речь идет о продуктах из конопли, содержащих КБД.
В соответствии с Федеральным законом о пищевых продуктах, лекарствах и косметических средствах (Закон FD&C) незаконно вводить в торговлю между штатами продукты питания (включая любые продукты или корма для животных), в которые было добавлено вещество, являющееся активным ингредиентом утвержденного лекарственного средства. продукт или вещество, для которых были начаты существенные клинические исследования, и существование таких исследований было обнародовано. 3 Точно так же эти типы веществ не подпадают под установленное законом определение пищевых добавок. Эти положения нашего устава существуют для защиты пациентов и сохранения доступа американских пациентов к самой безопасной и передовой фармацевтической системе в мире. Я думаю, что все в этом Комитете могут понять, почему в целом добавление лекарств, таких как лекарства от кровяного давления или химиотерапевтические средства, в продукты питания или в продукты, продаваемые как пищевые добавки, может не отвечать интересам американских потребителей и пациентов.
продукт или вещество, для которых были начаты существенные клинические исследования, и существование таких исследований было обнародовано. 3 Точно так же эти типы веществ не подпадают под установленное законом определение пищевых добавок. Эти положения нашего устава существуют для защиты пациентов и сохранения доступа американских пациентов к самой безопасной и передовой фармацевтической системе в мире. Я думаю, что все в этом Комитете могут понять, почему в целом добавление лекарств, таких как лекарства от кровяного давления или химиотерапевтические средства, в продукты питания или в продукты, продаваемые как пищевые добавки, может не отвечать интересам американских потребителей и пациентов.
В июне 2018 года FDA одобрило препарат Epidiolex 4 для лечения судорог, связанных с двумя очень редкими и тяжелыми детскими заболеваниями. Одобрение этого лекарства стало важной вехой для этих пациентов и их семей. Активным ингредиентом этого препарата является CBD. Основываясь как на одобрении этого препарата, так и на предыдущих существенных клинических исследованиях CBD, CBD не может продаваться в качестве пищевой добавки, а продукты, в которые был добавлен CBD, не могут быть введены в торговлю между штатами в соответствии с Законом FD&C. Положения Закона FD&C, запрещающие добавление активного ингредиента лекарственного средства в пищевые продукты или продажу активного ингредиента лекарственного средства в качестве пищевой добавки, содержат исключение, если лекарство продавалось в пищевых продуктах или пищевых добавках до того, как лекарство было одобрено и до того, как оно было подвергнуто существенным клиническим исследованиям. . Агентству не известно о каких-либо доказательствах того, что КБД продавался в пищевых продуктах или пищевых добавках до того, как он подвергся серьезному клиническому исследованию. Таким образом, FDA пришло к выводу, что это исключение не распространяется на КБД.
Основываясь как на одобрении этого препарата, так и на предыдущих существенных клинических исследованиях CBD, CBD не может продаваться в качестве пищевой добавки, а продукты, в которые был добавлен CBD, не могут быть введены в торговлю между штатами в соответствии с Законом FD&C. Положения Закона FD&C, запрещающие добавление активного ингредиента лекарственного средства в пищевые продукты или продажу активного ингредиента лекарственного средства в качестве пищевой добавки, содержат исключение, если лекарство продавалось в пищевых продуктах или пищевых добавках до того, как лекарство было одобрено и до того, как оно было подвергнуто существенным клиническим исследованиям. . Агентству не известно о каких-либо доказательствах того, что КБД продавался в пищевых продуктах или пищевых добавках до того, как он подвергся серьезному клиническому исследованию. Таким образом, FDA пришло к выводу, что это исключение не распространяется на КБД.
Закон FD&C также разрешает Агентству делать исключения посредством уведомления и комментариев к одному или обоим положениям, запрещающим добавлять активные лекарственные ингредиенты в пищевые продукты или продавать их в качестве пищевых добавок. Важно отметить, что может потребоваться от трех до пяти лет, чтобы завершить даже ускоренный процесс нормотворчества, который соответствует Закону об административных процедурах и другим требованиям. Завершение нормотворчества требует от Агентства разработки надежной документации для поддержки нормотворчества, включая экономический анализ, и рассмотрения комментариев общественности, которые могут быть объемными, когда нормотворчество касается существенных тем, вызывающих широкий общественный интерес, как в случае КБР.
Важно отметить, что может потребоваться от трех до пяти лет, чтобы завершить даже ускоренный процесс нормотворчества, который соответствует Закону об административных процедурах и другим требованиям. Завершение нормотворчества требует от Агентства разработки надежной документации для поддержки нормотворчества, включая экономический анализ, и рассмотрения комментариев общественности, которые могут быть объемными, когда нормотворчество касается существенных тем, вызывающих широкий общественный интерес, как в случае КБР.
Создание исключения для активного лекарственного ингредиента, который будет использоваться либо в пищевых продуктах, либо в пищевых добавках, имело бы смысл только в том случае, если бы мы могли определить, что продукты смогут соответствовать другим соответствующим стандартам безопасности в Законе FD&C, таким как безопасность пищевых добавок. стандарты для продуктов питания человека или животных или стандарты новых пищевых ингредиентов для пищевых добавок. Если бы мы создали исключение в соответствии с одним положением Закона о FD&C, но другие положения закона по-прежнему запрещали бы выпуск продукции на рынок, наши действия могли бы в конечном итоге создать дополнительную путаницу на рынке — результат, который, по мнению Агентства, предпочли бы все заинтересованные стороны. избегать.
избегать.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) признает, что от трех до пяти лет — это долгий срок для ожидания нормативной ясности, особенно с учетом значительного общественного интереса к продуктам из конопли и, в частности, к КБД. Вот почему, как я более подробно расскажу позже в своих показаниях, Агентство изучает варианты более быстрого и эффективного решения проблемы.
Каннабидиол (CBD)
Прошло всего семь месяцев с тех пор, как Закон о фермерских хозяйствах 2018 года исключил коноплю, которая включает производные каннабиса с низким содержанием ТГК, такие как продукты CBD, из определения марихуаны в CSA. Я не могу переоценить, насколько значительным изменением политики это было. До принятия Закона о фермерских хозяйствах 2018 года CSA не делало различий между марихуаной и коноплей, и весь каннабис (за некоторыми исключениями, например, стерилизованные семена и зрелые стебли растения) был веществом Списка I и поэтому контролировался Управлением по борьбе с наркотиками.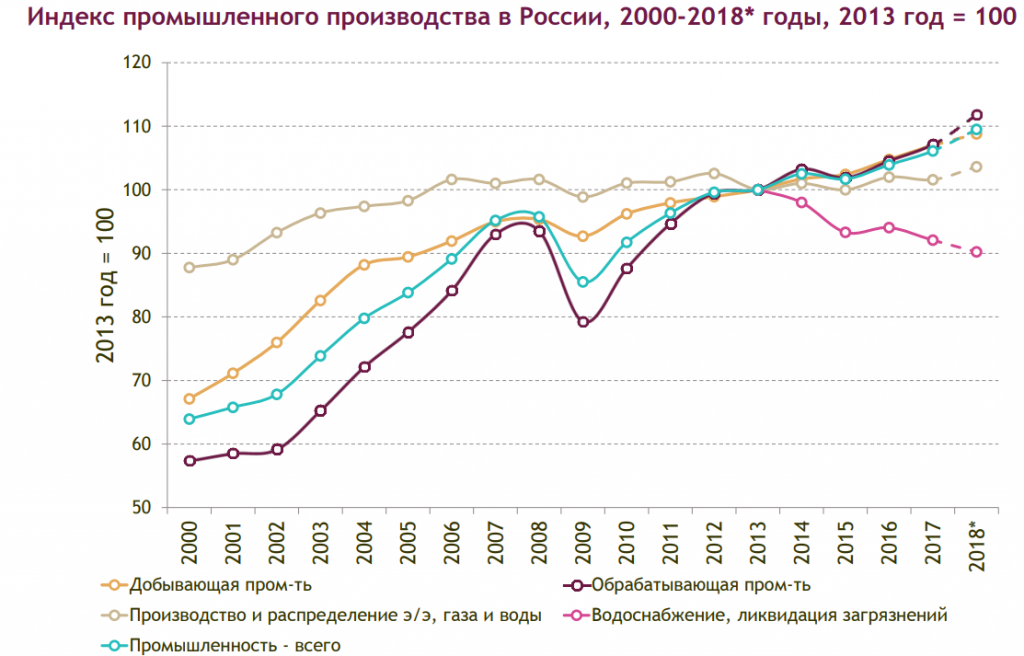 Администрация (DEA). Ранний интерес к клиническим исследованиям был сосредоточен на разработке лекарств с использованием ТГК, а не КБД. В последнее время интерес к КБД как лекарству возрастает, и, как обсуждалось выше, FDA одобрило Epidiolex в 2018 году, препарат для лечения двух тяжелых форм детских судорог.
Администрация (DEA). Ранний интерес к клиническим исследованиям был сосредоточен на разработке лекарств с использованием ТГК, а не КБД. В последнее время интерес к КБД как лекарству возрастает, и, как обсуждалось выше, FDA одобрило Epidiolex в 2018 году, препарат для лечения двух тяжелых форм детских судорог.
Принятие Закона о фермерских хозяйствах 2018 года привело к неправильному представлению о том, что все продукты, изготовленные из конопли или содержащие ее, в том числе изготовленные с использованием КБД, теперь разрешены для продажи в межгосударственной торговле. В результате витрины магазинов и интернет-магазины наводнили рынок этими продуктами, многие из которых имеют необоснованные терапевтические заявления. FDA обнаружило, что CBD появляется в самых разных продуктах, включая продукты питания, пищевые добавки, ветеринарные продукты и косметику. По мере появления этого нового рынка мы наблюдаем значительный интерес со стороны промышленности, потребителей и Конгресса. Однако среди волнений и инноваций роль FDA остается прежней: защищать и укреплять здоровье населения.
В настоящее время любые продукты питания CBD или предполагаемые пищевые добавки в торговле между штатами являются нарушением Закона FD&C из-за законодательных положений, обсуждавшихся выше. Тем не менее, наибольшую озабоченность FDA вызывает маркетинг продуктов CBD, которые делают необоснованные терапевтические заявления для предотвращения, диагностики, смягчения последствий, лечения или лечения серьезных заболеваний, но не получили новых разрешений на лекарства. Например, FDA видело различные продукты CBD с заявлениями об излечении рака или болезни Альцгеймера. Распространение таких продуктов может отпугнуть потребителей от поиска проверенных и безопасных медицинских методов лечения серьезных заболеваний, потенциально угрожающих их здоровью или жизни. Обязательство FDA защищать потребителей от этих необоснованных терапевтических заявлений распространяется не только на продукты CBD — это давнее обязательство Агентства по всем продуктам, которые мы регулируем.
FDA выпустило многочисленные предупреждающие письма фирмам, продающим неутвержденные лекарственные препараты CBD, с заявлениями о лечении или профилактике серьезных заболеваний, и фактически Агентство начало делать это в 2015 году, до принятия Закона о фермах 2018 года 5 . Также стоит отметить, что при расследовании этих неутвержденных лекарственных препаратов CBD FDA выявило другие проблемы. Например, лабораторный анализ некоторых из этих продуктов показал, что они не содержат количества КБД, указанного на этикетке продукта, и/или продукты содержат другие вещества, которых нет на этикетке продукта, например другие каннабиноиды, такие как ТГК.
Также стоит отметить, что при расследовании этих неутвержденных лекарственных препаратов CBD FDA выявило другие проблемы. Например, лабораторный анализ некоторых из этих продуктов показал, что они не содержат количества КБД, указанного на этикетке продукта, и/или продукты содержат другие вещества, которых нет на этикетке продукта, например другие каннабиноиды, такие как ТГК.
Благодаря одобрению препарата Epidiolex, содержащего CBD, которое было основано на адекватных и хорошо контролируемых клинических исследованиях, FDA узнало, что CBD не является безопасным веществом. Во время нашего обзора маркетинговой заявки на Эпидиолекс мы выявили определенные риски безопасности, в том числе возможность повреждения печени 6 . В этом контексте риски перевешиваются преимуществами одобренного препарата для конкретной группы населения, для которой он был предназначен.
Процесс утверждения лекарств дает значительные преимущества врачам и пациентам, в том числе тем, кто хочет назначать или использовать продукты из конопли в терапевтических целях. Утверждения лекарственных средств, как правило, основаны на адекватных и хорошо контролируемых клинических исследованиях, что дает врачам и пациентам уверенность в безопасности и эффективности лекарственного средства для его показанного применения. Кроме того, одобренные препараты имеют одинаковую силу действия и постоянную доставку, что обеспечивает адекватную дозировку, необходимую для лечения пациентов, особенно пациентов со сложными и серьезными состояниями, такими как синдромы эпилепсии, для лечения которых был одобрен Epidiolex. Более того, пациенты, использующие утвержденный рецептурный препарат, находятся под медицинским наблюдением для отслеживания любых потенциальных побочных эффектов препарата. Но для потребителей, покупающих продукты CBD, которые широко распространены на рынке, эти защитные факторы, как правило, отсутствуют.
Утверждения лекарственных средств, как правило, основаны на адекватных и хорошо контролируемых клинических исследованиях, что дает врачам и пациентам уверенность в безопасности и эффективности лекарственного средства для его показанного применения. Кроме того, одобренные препараты имеют одинаковую силу действия и постоянную доставку, что обеспечивает адекватную дозировку, необходимую для лечения пациентов, особенно пациентов со сложными и серьезными состояниями, такими как синдромы эпилепсии, для лечения которых был одобрен Epidiolex. Более того, пациенты, использующие утвержденный рецептурный препарат, находятся под медицинским наблюдением для отслеживания любых потенциальных побочных эффектов препарата. Но для потребителей, покупающих продукты CBD, которые широко распространены на рынке, эти защитные факторы, как правило, отсутствуют.
Приверженность FDA обоснованной, научно обоснованной политике в отношении CBD
Учитывая значительный интерес общественности, промышленности и Конгресса к CBD, FDA сформировало рабочую группу высокого уровня по политике CBD, которую я сопредседательствую вместе с Лоуэллом Шиллером, который является главным ассоциированным комиссаром Агентства по вопросам политики. Целью Рабочей группы по политике в отношении КБР является координация подхода Агентства к разработке политики в отношении КБР, в том числе рассмотрение целесообразности потенциальных путей законного сбыта пищевых добавок и/или обычных пищевых продуктов, содержащих КБР.
Целью Рабочей группы по политике в отношении КБР является координация подхода Агентства к разработке политики в отношении КБР, в том числе рассмотрение целесообразности потенциальных путей законного сбыта пищевых добавок и/или обычных пищевых продуктов, содержащих КБР.
Первоочередной задачей Рабочей группы по политике КБР было получение и оценка данных о безопасности КБР, учитывая миссию Агентства в области общественного здравоохранения. Хотя FDA одобрило один препарат, Epidiolex, который содержит CBD, Epidiolex одобрен для использования в ограниченной популяции в определенной дозе, безопасность и эффективность изучались в строгих рандомизированных клинических испытаниях, и он доступен только по рецепту от лицензированного медицинского учреждения. профессиональный. При рассмотрении вопроса об использовании КБД в немедикаментозных продуктах, таких как обычные продукты питания и пищевые добавки, FDA должно оценивать другие факторы, чем в случае рецептурного лекарственного препарата. Пищевые продукты и пищевые добавки с КБД будут напрямую доступны для широкого круга потребителей, которые потенциально могут включать беременных или кормящих матерей, детей, пожилых людей, людей с хроническими заболеваниями и тех, кто принимает лекарства, которые могут взаимодействовать с КБД. Продукты CBD также можно давать широкому кругу видов животных, некоторые из которых используются в пищу. Они также будут доступны без обсуждения с врачом или другим медицинским работником. Учитывая это, FDA должно учитывать потенциальные последствия для безопасности длительного использования КБД различными популяциями людей и животных.
Пищевые продукты и пищевые добавки с КБД будут напрямую доступны для широкого круга потребителей, которые потенциально могут включать беременных или кормящих матерей, детей, пожилых людей, людей с хроническими заболеваниями и тех, кто принимает лекарства, которые могут взаимодействовать с КБД. Продукты CBD также можно давать широкому кругу видов животных, некоторые из которых используются в пищу. Они также будут доступны без обсуждения с врачом или другим медицинским работником. Учитывая это, FDA должно учитывать потенциальные последствия для безопасности длительного использования КБД различными популяциями людей и животных.
FDA борется с вопросами не только о внутренней безопасности CBD, но и о потенциально небезопасных производственных процессах для продуктов, содержащих CBD. FDA знает из протестированных продуктов CBD, что они могут не содержать количества CBD, указанного на этикетке, или могут содержать другие потенциально опасные соединения, которые не указаны на этикетке. Поэтому FDA должно рассмотреть вопросы, связанные с надлежащей производственной практикой продуктов CBD и потенциальной маркировкой, которая может быть уместной для этих продуктов, чтобы устранить любые потенциальные риски для потребителей.
Поэтому FDA должно рассмотреть вопросы, связанные с надлежащей производственной практикой продуктов CBD и потенциальной маркировкой, которая может быть уместной для этих продуктов, чтобы устранить любые потенциальные риски для потребителей.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов сделало решение этих вопросов своим приоритетом, и мы прилагаем все усилия, чтобы добиться прогресса. Тем не менее, FDA рассмотрит возможность создания законных путей для продажи КБД в качестве пищевой добавки или продукта питания только в том случае, если Агентство будет уверено, что оно может разработать основу для решения проблем безопасности. Еще один вопрос, который FDA планирует рассмотреть, заключается в том, будет ли разрешение на продажу КБД в качестве пищевой добавки или продукта питания сдерживать клинические исследования для обоснования дополнительных терапевтических применений соединений, полученных из каннабиса. Меньше исследований перспективных соединений, полученных из каннабиса, и меньшее количество разрешений на лекарства в этой области было бы значительной потерей для американских пациентов.
Прислушиваться к заинтересованным сторонам и учиться у них
В рамках обязательства Агентства по привлечению общественности к продуктам каннабиса и их производным мы провели публичные слушания 31 мая 2019 года. Целью публичных слушаний было получение научных данных и информация о безопасности, производстве, качестве продукции, маркетинге, маркировке и продаже продуктов, содержащих каннабис или соединения, полученные из каннабиса. В слушаниях лично приняли участие более 600 человек, еще более 2000 просмотрели его в режиме онлайн и включали презентации более 100 докладчиков, представляющих широкий и разнообразный круг заинтересованных сторон, включая пациентов, потребителей и их группы защиты; поставщики медицинских услуг; научные круги; производители, розничные торговцы и дистрибьюторы; сельскохозяйственные коалиции; а также представители государственных, племенных и местных органов власти.
Публичные слушания подняли множество вопросов, в том числе потребность в большем количестве и более качественных данных о преимуществах и рисках КБД, опасения, связанные с производством, фальсификацией и незаконным маркетингом продуктов, и даже такие простые, как необходимость согласованной терминологии, связанной с каннабисом.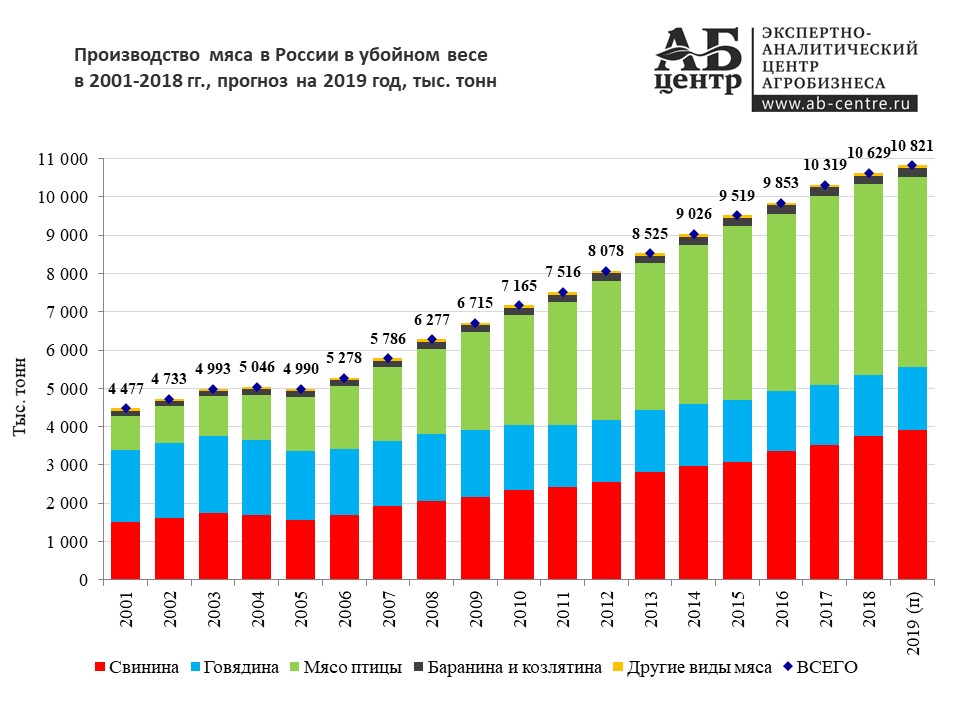 продукты. Мы открыли публичный список для сбора комментариев в рамках публичных слушаний, и он закрылся только 16 июля 2019 года. Мы получили 4492 комментария, отправленных в список, которые мы рассмотрели. По мере решения этой проблемы мы стремимся открыто сообщать общественности о нашем пути вперед и предоставлять информацию, основанную на достоверных научных данных и данных.
продукты. Мы открыли публичный список для сбора комментариев в рамках публичных слушаний, и он закрылся только 16 июля 2019 года. Мы получили 4492 комментария, отправленных в список, которые мы рассмотрели. По мере решения этой проблемы мы стремимся открыто сообщать общественности о нашем пути вперед и предоставлять информацию, основанную на достоверных научных данных и данных.
Мы понимаем, что производители конопли, производители продуктов питания и пищевых добавок, фармацевтическая промышленность, розничные торговцы, академические учреждения, пациенты и потребители хотят и нуждаются в нормативной определенности в этой области. Агентство также опубликовало несколько заявлений после принятия Закона о фермерских хозяйствах 2018 года, чтобы информировать общественность о текущей нормативной базе и наших усилиях по рассмотрению целесообразности потенциальных новых путей для продуктов каннабиса 7 . Мы также поддерживаем страницу вопросов и ответов о продуктах каннабиса, чтобы помочь ответить на вопросы общественности и наших заинтересованных сторон 8 . Мы стремимся держать общественность в курсе этой развивающейся области.
Мы стремимся держать общественность в курсе этой развивающейся области.
Работа с нашими федеральными, государственными, племенными и местными партнерами
FDA признает, что наш подход к регулированию продуктов из конопли должен осуществляться в тесном сотрудничестве с нашими федеральными, государственными, племенными и местными партнерами по регулированию.
Во-первых, я хотел бы поблагодарить своих коллег из Министерства сельского хозяйства США и Агентства по охране окружающей среды, которые также дают показания сегодня. FDA поддерживает прочные отношения с этими агентствами, и мы тесно сотрудничаем с ними, поскольку Министерство сельского хозяйства США и штаты реализуют положения о конопле в Законе о фермах 2018 года.
Сотрудники и руководители FDA и USDA участвовали в многочисленных встречах и беседах по вопросам каннабиса. К ним относится недавняя конференция с участием старших руководителей Программы специальных культур Службы сельскохозяйственного маркетинга Министерства сельского хозяйства США для обсуждения соответствующих ролей и обязанностей агентств. FDA и USDA поддерживают тесные контакты по этому вопросу.
FDA и USDA поддерживают тесные контакты по этому вопросу.
FDA и EPA постоянно обмениваются информацией. Например, ранее этой весной FDA предоставило Управлению программ по пестицидам EPA информацию о регулировании FDA в отношении каннабиса и продуктов, полученных из каннабиса, включая информацию о недавних публичных слушаниях. FDA и EPA продолжают поддерживать связь по этому вопросу и планируют дальнейшее совместное обсуждение в будущем.
FDA тесно сотрудничает с нашими государственными, племенными и местными партнерами, чтобы помочь им ориентироваться в регулировании продуктов из конопли, в том числе тех, которые содержат CBD. Ряд штатов, племен и местных юрисдикций приняли различные законы, декриминализирующие или разрешающие различные типы соединений или продуктов каннабиса в соответствии с законодательством штата. FDA также известно, что продукты, содержащие CBD, стали доступны в этих юрисдикциях, а также в юрисдикциях, которые не приняли никаких законов, связанных с легализацией каннабиса.
Мы по-прежнему привержены продвижению вперед в области регулирования продуктов из конопли в тесном сотрудничестве с нашими федеральными, государственными и местными партнерами.
Сохранение стимулов для исследований и разработки лекарств
Хотя FDA рассматривает возможность новых легальных путей для продуктов CBD, мы знаем, что важно поддерживать адекватные стимулы для исследований и разработок лекарств. Лекарства имеют важное терапевтическое значение и одобрены после тщательных научных исследований, дающих важную новую информацию о терапевтическом применении. Крайне важно, чтобы мы продолжали делать все возможное для поддержки науки, необходимой для разработки новых лекарств из каннабиса. На сегодняшний день FDA одобрило четыре препарата, которые содержат активные ингредиенты, представляющие собой каннабиноиды, обнаруженные в растении каннабис или связанные с ним. В дополнение к Epidiolex, который содержит очищенный CBD растительного происхождения и был одобрен для лечения двух редких форм детской эпилепсии, FDA одобрило три препарата, содержащие другие каннабиноиды, для лечения побочных эффектов химиотерапии, таких как тошнота 9 . Среди этих трех продуктов два содержат синтетически полученный дронабинол, который химически идентичен ТГК, а третий содержит набилон, синтетический химический аналог ТГК, не встречающийся в природе в каннабисе.
Среди этих трех продуктов два содержат синтетически полученный дронабинол, который химически идентичен ТГК, а третий содержит набилон, синтетический химический аналог ТГК, не встречающийся в природе в каннабисе.
FDA также получило отзывы от заинтересованных сторон, заинтересованных в проведении исследований с каннабисом и КБД. FDA обязуется делать все возможное для содействия и сохранения стимулов для клинических исследований. Мы обеспокоены тем, что широкая доступность КБД в таких продуктах, как продукты питания или пищевые добавки, может уменьшить коммерческие стимулы к изучению КБД для потенциального применения в лекарствах, что было бы потерей для пациентов.
Для проведения клинических исследований, которые потенциально могут привести к утверждению нового лекарственного средства, исследователи должны подать заявку на исследование нового лекарственного средства в Центр оценки и исследований лекарственных средств FDA. Для использования в качестве лекарственного препарата для животных исследователи создадут файл Investigational New Animal Drug с Центром ветеринарной медицины FDA.
Поскольку Закон о фермерских хозяйствах 2018 г. исключил коноплю из определения марихуаны в CSA, это изменение может упростить для исследователей процесс изучения определенных производных каннабиса, которые содержат не более 0,3% ТГК по сухому весу, включая каннабиноиды, такие как КБД, которые может способствовать разработке новых лекарств из этих веществ.
Заключение
Закон о фермерских хозяйствах 2018 года внес огромные изменения в регулирование продуктов из конопли, и FDA полностью привержено работе, которая предстоит в этой области. Работаем и будем работать быстро и качественно. Мы признаем значительный интерес и потенциал этой культуры для фермеров в Соединенных Штатах. FDA надеется информировать Конгресс и заинтересованные стороны о нашей работе по выводу на рынок соответствующих продуктов из конопли с помощью существующих путей регулирования, а также о наших усилиях по определению того, подходят ли дополнительные нормативные рамки для продуктов, содержащих КБД. Наша работа над продуктами из конопли будет по-прежнему основываться на нашей миссии в области общественного здравоохранения и нашей приверженности разработке разумной, научно обоснованной политики.
Наша работа над продуктами из конопли будет по-прежнему основываться на нашей миссии в области общественного здравоохранения и нашей приверженности разработке разумной, научно обоснованной политики.
Спасибо за возможность обсудить правила FDA в отношении продуктов из конопли. Буду рад ответить на любые вопросы.
Сноски
1. https://www.fda.gov/food/cfsan-constituent-updates/fda-responds-three-gras-notices-hemp-seed-derived-ingredients-use-human-food
2. https://www.govinfo.gov/content/pkg/PLAW-111publ353/pdf/PLAW-111publ353.pdf
3. См. Закон FD&C, раздел 301(ll) и раздел 201(ff)(3)( B)
4. https://www.fda.gov/news-events/press-announcements/fda-approves-first-drug-comprised-active-ingredient-derived-marijuana-treat-rare-severe-forms.
5. https://www.fda.gov/news-events/public-health-focus/warning-letters-and-test-results-cannabidiol-related-products.
6. https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/210365lbl.
