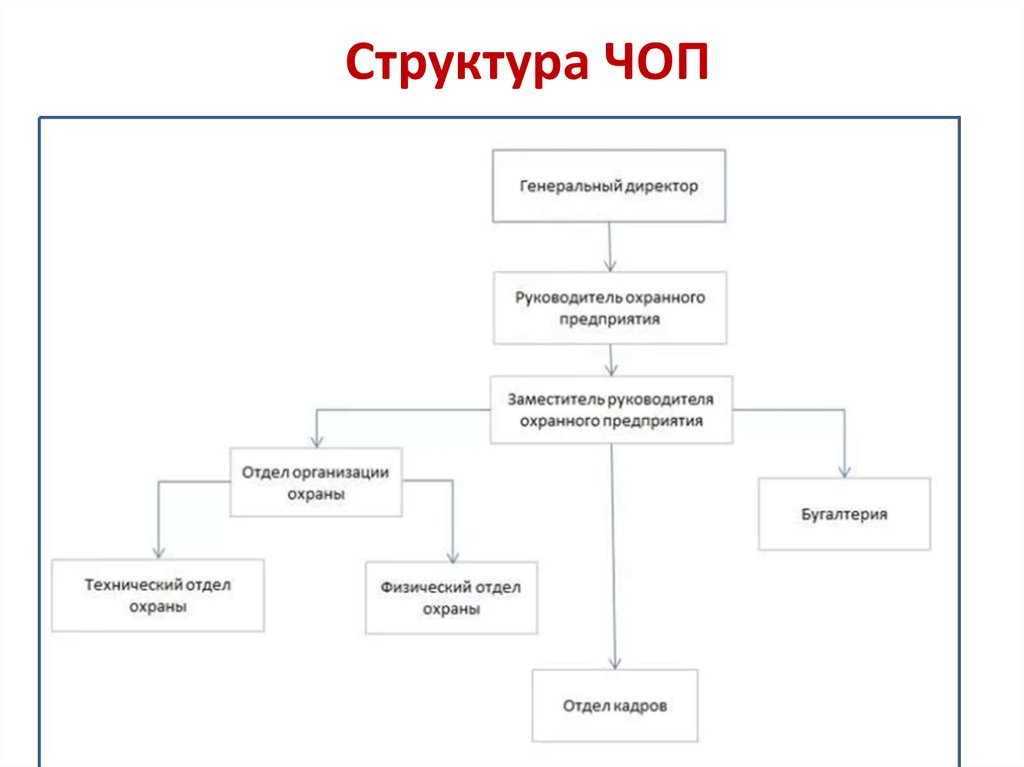
Структура ЧОП | Jobmens.ru
Когда мы слышим о сфере охраны и безопасности, первая мысль возникает о том, что эта сфера состоит только из охранников. Но это не так: охранная отрасль в России очень хорошо развита и в ней задействованы тысячи и тысячи сотрудников разных специальностей. Предлагаю рассмотреть профессии этой отрасли на примере стандартной структуры организации частного охранного предприятия:Частное охранное предприятие, как правило, состоит из 6 департаментов:РуководствоОтдел персоналаДепартамент охраныДепартамент развитияДепартамент юридической и правовой защитыБухгалтерский отделВ приведенной выше схеме отдел персонала не случайно находится в центре – потому что отдел кадров является самым важным ресурсом, необходимый для функционирования всех остальных департаментов. Собственно, для любой организации наличие грамотно подобранного персонала определяет успешность работы всей организации, но в охранной сфере это особенно замечается.Как мы видим в структуре, специфику частного охранного предприятия определяет только наличие департамента охраны. Нормальная работа департамента охраны в частной охранной организации полностью зависит от наличия в составе отдела таких профессий, как руководитель департамента охраны – специалист, который полностью курирует всю охранную деятельность, осуществляемую ЧОП. В подчинении у руководителя этого департамента находятся:Начальник объектов – полностью отвечает за работу охраны на объектах, назначает начальников смены, определяет порядок работы охраны на объектахИнспектор охраны – поддерживает установленные режимы охраны на объектах, следит за безопасностью на территории объекта, курирует начальников сменыНачальник смены охраны – в обязанностях: охрана объекта, руководство сменой, разрешение внештатных ситуацийОхранник – специалист, имеющий удостоверение и право на осуществление охранной деятельности, осуществляющий охрану объектаКонтролера, как правило, можно встретить в магазинах и супермаркетах, и это не случайно: специалист контроля выполняет те же самые базовые функции, что и у охранника, но с некоторыми отступлениями.
Нормальная работа департамента охраны в частной охранной организации полностью зависит от наличия в составе отдела таких профессий, как руководитель департамента охраны – специалист, который полностью курирует всю охранную деятельность, осуществляемую ЧОП. В подчинении у руководителя этого департамента находятся:Начальник объектов – полностью отвечает за работу охраны на объектах, назначает начальников смены, определяет порядок работы охраны на объектахИнспектор охраны – поддерживает установленные режимы охраны на объектах, следит за безопасностью на территории объекта, курирует начальников сменыНачальник смены охраны – в обязанностях: охрана объекта, руководство сменой, разрешение внештатных ситуацийОхранник – специалист, имеющий удостоверение и право на осуществление охранной деятельности, осуществляющий охрану объектаКонтролера, как правило, можно встретить в магазинах и супермаркетах, и это не случайно: специалист контроля выполняет те же самые базовые функции, что и у охранника, но с некоторыми отступлениями. Он должен знать кассовый аппарат и принципы его работы, а так же знать ассортимент товара, чтобы уметь по чеку определить наличие правонарушения в магазинеВахтер –человек, осуществляющий дежурную деятельность на объекте.Остальные департаменты или отделы характерны, в принципе, для любой организации. Но есть одно большое «НО».Дело в том, что, как правило, подобрать юриста или бухгалтера в ЧОП – задача не из простых, потому что бухгалтер в охранной сфере должен объединять в себе и бухгалтерские, и экономические функции – расчета и планирования расхода средств. А юрист в ЧОПе должен скорее исполнять обязанности юрисконсульта – специалиста по соблюдению правовых взаимоотношений характерных для сферы охраны и безопасности. Менеджеры по развитию и рекламе должны знать особенности целевой аудитории ЧОПов, чтобы уметь правильно распространять информацию в этой сфере.Поэтому устроиться на работу в ЧОП на должность юриста, менеджера или бухгалтера – сложно, как правило, для этого требуется наличие немалого опыта работы и специфических знаний.
Он должен знать кассовый аппарат и принципы его работы, а так же знать ассортимент товара, чтобы уметь по чеку определить наличие правонарушения в магазинеВахтер –человек, осуществляющий дежурную деятельность на объекте.Остальные департаменты или отделы характерны, в принципе, для любой организации. Но есть одно большое «НО».Дело в том, что, как правило, подобрать юриста или бухгалтера в ЧОП – задача не из простых, потому что бухгалтер в охранной сфере должен объединять в себе и бухгалтерские, и экономические функции – расчета и планирования расхода средств. А юрист в ЧОПе должен скорее исполнять обязанности юрисконсульта – специалиста по соблюдению правовых взаимоотношений характерных для сферы охраны и безопасности. Менеджеры по развитию и рекламе должны знать особенности целевой аудитории ЧОПов, чтобы уметь правильно распространять информацию в этой сфере.Поэтому устроиться на работу в ЧОП на должность юриста, менеджера или бухгалтера – сложно, как правило, для этого требуется наличие немалого опыта работы и специфических знаний.
ДОЛЖНОСТИ В ЧАСТНОЙ ОХРАННОЙ ДЕЯТЕЛЬНОСТИ 2020
Хотя деятельность ЧОП на территории Российской Федерации получила правовой статус еще в 1992 году, вопрос о точной должностной иерархии в таких подразделениях остается открытым по сегодняшний день. Должности в охранном предприятии, конечно же, есть, их фиксируют в уставных документах, и для каждой из них установлены определенные обязанности. Тем не менее, к концу 2020 года единый список должностей в ЧОПе так и не появился.
Руководство каждой охранной организации самостоятельно формирует списки должностей, основываясь на опыте других. Поэтому и мы в нашей статье будем придерживаться такого принципа. Здесь мы приведем общую должностную иерархию, характерную для ЧОП Москвы, Санкт-Петербурга, Краснодара и других городов РФ. Также в статье вы найдете ответ на вопрос о том, какие должности есть в ЧОПах непосредственно у охранников.
ОБЩАЯ СТРУКТУРА ОХРАННОГО ПРЕДПРИЯТИЯ
В целом должностная иерархия ЧОП не отличается от стандартной структуры, характерной для большинства компаний и организаций.
- РУКОВОДСТВО ВЫСШЕГО ЗВЕНА. Сюда входят директор и его заместители. Они осуществляют контроль и управление над деятельностью всей организации. Нередко руководители высшего звена являются непосредственно владельцами или учредителями.
- РУКОВОДИТЕЛИ СРЕДНЕГО ЗВЕНА. Сюда относятся начальники команд, старшие секторов и смен на крупных объектах. В подчинении у них обычно находятся 3-4 руководителя младшего звена и около 20 рядовых охранников. К этой же категории относятся специалисты среднего звена (сотрудники технических подразделений и отделов).
- РУКОВОДСТВО МЛАДШЕГО ЗВЕНА. В этой категории представлены должности ЧОП, аналогичные должностям рядового состава, но с приставкой «старший». В подчинении старшего охранника поста, экипажа, патруля и других формирований находится до 5 человек.
-
РЯДОВОЙ СОСТАВ.
 Эта нижняя, но самая разнообразная «ступень пирамиды» охватывает более десятка должностей. Выбор зависит от специфики деятельности ЧОП и его масштабов.
Эта нижняя, но самая разнообразная «ступень пирамиды» охватывает более десятка должностей. Выбор зависит от специфики деятельности ЧОП и его масштабов.
На должностях рядовых охранников ЧОП (последний пункт списка) остановимся более детально. Эта категория включает самое большое число возможных позиций. Рядовой охранник ЧОП может работать в досмотровой, патрульной или мобильной группах, в группе сопровождения и ГБР. Отдельно выделяют должности охранника-экспедитора, инкассатора и телохранителя. Причем во многих случаях лицензированные охранники ЧОП совмещают сразу несколько должностей.
Как уже отмечалось, точный выбор должностей для охранного предприятия осуществляет его руководство. На момент написания этой статьи (осень 2020) единой должностной иерархии для ЧОП России не существовало. Если же в дальнейшем ситуация изменится, вы обязательно найдете актуальный список должностей в ЧОП на нашем сайте. Кроме того, наши консультанты всегда предоставят вам подробную информацию о структуре охранных организаций.
Работа в ЧОП | ЧОП НИИ
Перейти к основному содержанию Добавить к любомуПоделиться:
«Одна команда, одно видение, одна миссия» — это основа для развития устойчивых и доверительных рабочих отношений в исследовательском сообществе Детской больницы Филадельфии. Исследователи всех уровней — от исследователей на пике своей карьеры до тех, кто изучает исследования как свою будущую карьеру — работают совместно с профессионалами в области управления исследованиями, чтобы продемонстрировать влияние исследований, управлять своими проектами с прозрачностью и управлением, а также повышать производительность при одновременном снижении административное бремя. Доступно множество ресурсов для эффективного, безопасного и профессионального участия в этих повседневных взаимодействиях. См. Организационную схему (слева), чтобы увидеть, как эта работа вписывается в соответствующие подразделения Исследовательского института.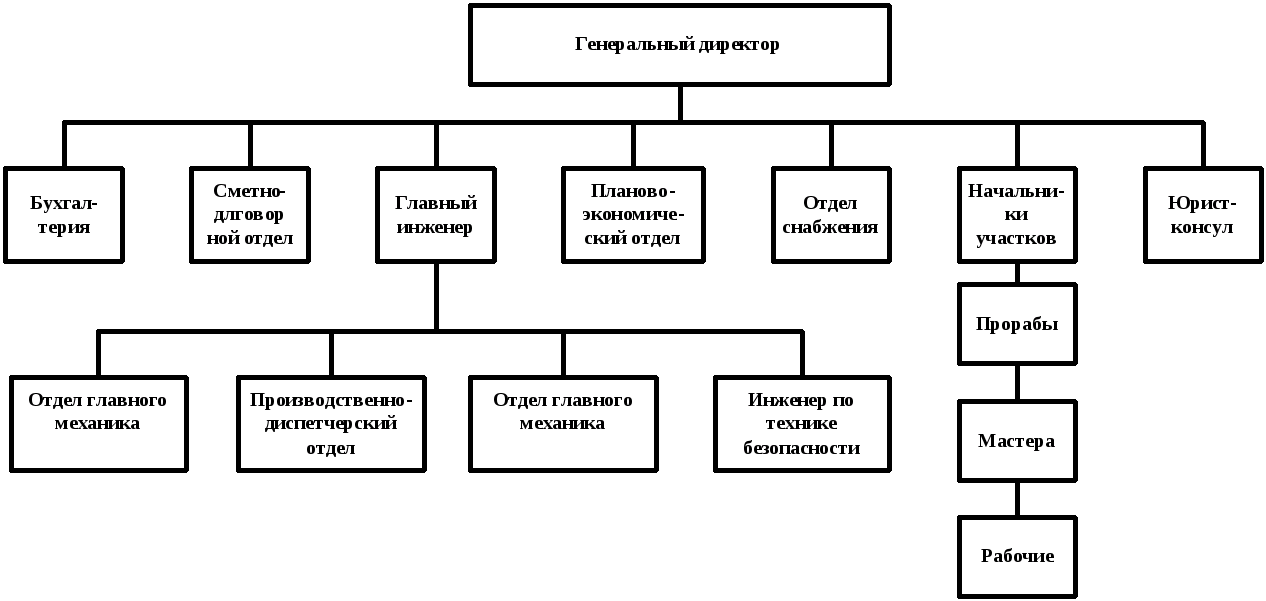
Приверженность CHOP улучшению здоровья и жизни детей является неотъемлемой частью нашей миссии и движущей силой выхода за пределы наших стен и участия в жизни общества. Отдел по связям с общественностью в CHOP поддерживает внутренние и внешние общественные программы, которые помогают удовлетворять потребности сообщества. Узнайте, как сотрудники CHOP могут поддержать эту важную работу посредством участия в общественной жизни и участия в волонтерских программах.
Узнать больше
Необходимые ресурсы для адаптации и найма новых сотрудников:
- Адаптационные службы и ресурсы — просмотр списка служб и ресурсов для новых сотрудников
- Организационная структура научно-исследовательского института – Посмотреть организационную структуру научно-исследовательского института
- Парковка и транспорт. Посетите пространство @CHOP, чтобы узнать больше о местном транспорте и парковочных ресурсах на CHOP .
Определите и выполните требования к обучению:
- MyCareer.
 Выполните обязательные требования к образованию и найдите онлайн-обучение и профессиональное развитие под руководством инструктора, чтобы сделать следующий шаг в своей карьере в CHOP.
Выполните обязательные требования к образованию и найдите онлайн-обучение и профессиональное развитие под руководством инструктора, чтобы сделать следующий шаг в своей карьере в CHOP. - Требования к обучению исследователям. Выполните требования к обучению в зависимости от вашей роли в Исследовательском институте .
- Обучение координатора клинических исследований — пройдите курс обучения координатора клинических исследований .
- Тренинги по безопасности в лаборатории — завершите обучение по безопасности в лаборатории
- Специализированные тренинги по безопасности исследований — полные тренинги, специализированные программы обучения безопасности
Найти ресурсы для работы в CHOP:
- @CHOP Инструменты и приложения
- Преимущества
- CHOP Go (Программа поездок и расходов)
- Coupa (управляемый инструмент для покупки)
- Портал запроса данных (дополнительная информация здесь)
- Корпоративная программа просмотра (NilRead)
- Электронное исследование
- Сервисный портал объектов
- Форма запроса на обслуживание помещений (x41046)
- Портал кадровой службы
- Портал обслуживания сотрудников
- моя Карьера @CHOP
- Новые фирменные шаблоны CHOP
- На базе
- Меню онлайн-лаборатории
- ПеннКи
- Диспетчер политик
- ReCHOP: Пожертвуйте неиспользуемые предметы! Найдите бесплатные списки!
- Virgin Pulse (Здоровье)
- РЕДКэп
- Форма доступа посетителей научно-исследовательского института
- Самостоятельный сброс пароля
- STAR/Kronos Время и отчетность
- Strata (Финансовый инструмент)
- Жезл (правильный выбор)
- Рабочий день
Ознакомьтесь с пошаговыми инструкциями о том, как начать клиническое исследование, и контрольным списком для команды, который поможет научному персоналу начать клиническое исследование.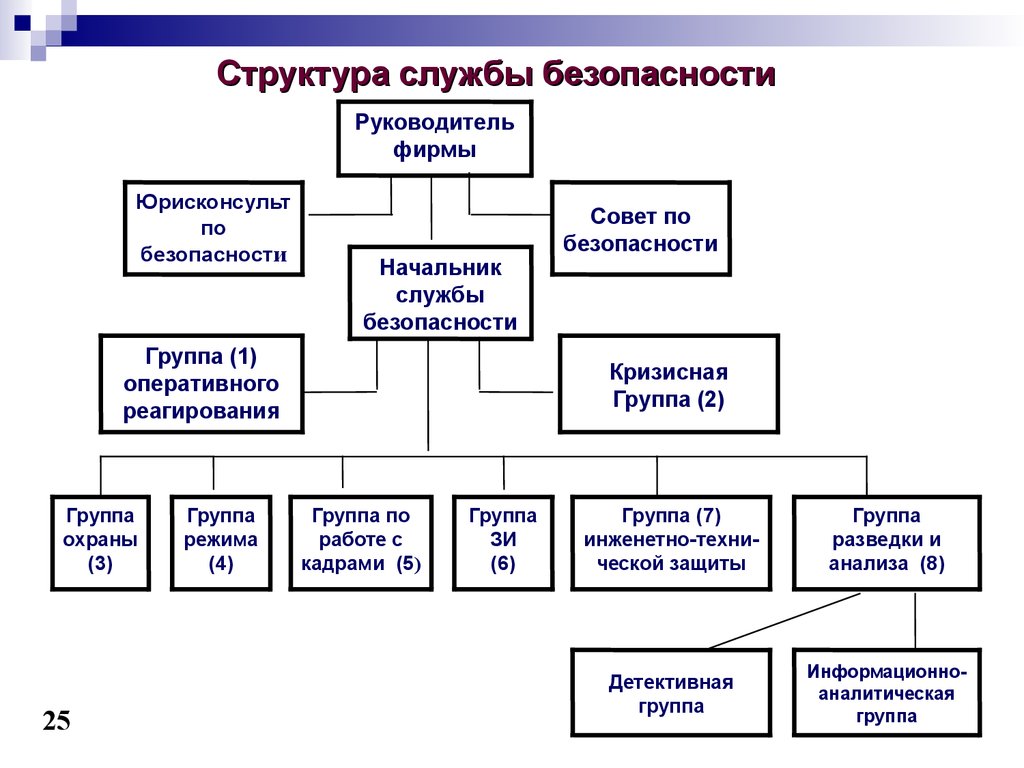
Дополнительные ресурсы для координаторов клинических исследований и научного персонала:
- Общие сокращения CHOP
- Исследование EPIC
- Онкоре
- Профессиональное общество детских клинических исследований PROSPER
- ПРОСПЕР Реестр
- Обучение координатора клинических исследований
- Формы и шаблоны / Интернет-присутствие IRB
- Лицензии и аккредитации
- Лабораторные эталонные диапазоны (патология и лабораторная медицина)
- Переводческие услуги
- Формы управления медицинской информацией (HIM)
Найдите ресурсы для групп и сотрудников, занимающихся фундаментальными научными исследованиями:
- Услуги по безопасности исследований и обучение
- Информация IACUC
- Обучение использованию и уходу за животными
Служба
Запрос на покупку компьютерного оборудования
Купить компьютерное оборудование.
Служба
Услуги РИС
Найдите список услуг, предоставляемых отделом Исследовательской Информации.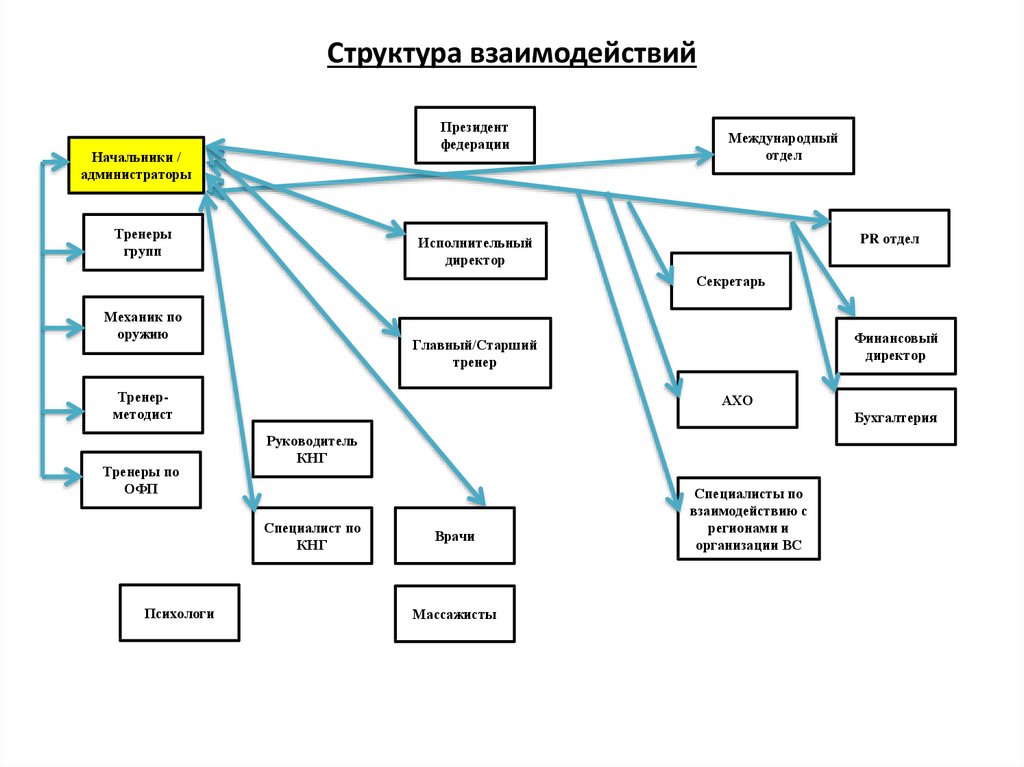
Служба
Услуги RCS
Воспользуйтесь многочисленными услугами, предлагаемыми для удовлетворения ваших потребностей в общении.
Wiki.CHOP.edu | ЧОП НИИ
Опубликовано 21 февраля 2020 г. · Последнее обновление 5 месяцев 1 неделю назад
аддто любойПоделиться:
ПОСМОТРЕТЬ ЭТУ СТРАНИЦУ
Подпишитесь, чтобы получать уведомления об изменениях или обновлениях на этой странице.
Введите адрес электронной почты:Что такое Wiki.CHOP?
Доступная извне вики-технология для совместной работы в команде, управления проектами и документами.
Двухфакторная аутентификация
В рамках усилий по повышению информационной безопасности Исследовательская информационная служба Детской больницы Филадельфии добавит в Wiki.CHOP двухфакторную аутентификацию.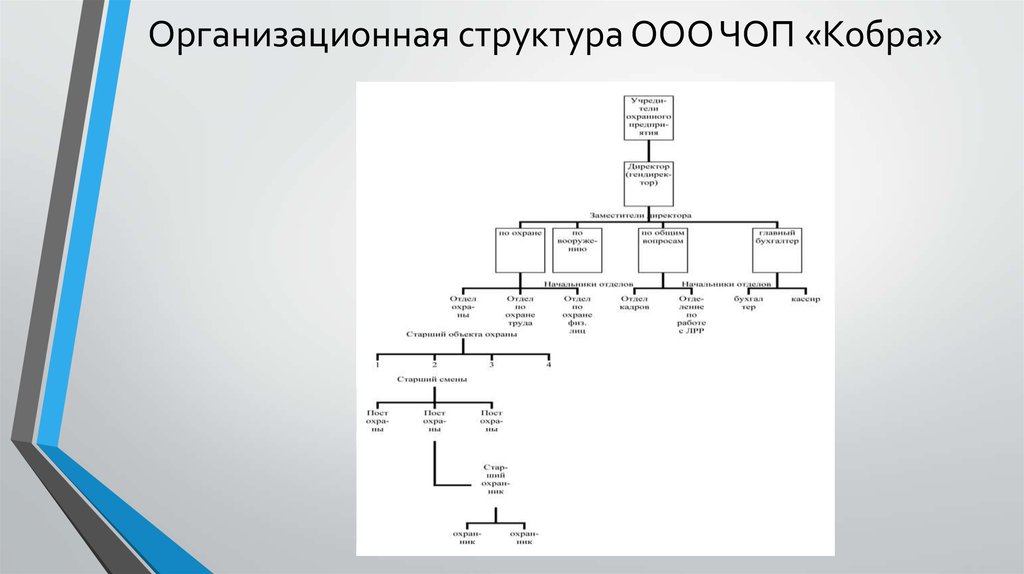
Wiki.CHOP будет продолжать работать вне и в кампусе для сотрудников CHOP и внешних сотрудников. Инструкции по входу в систему для сотрудников и соавторов, вошедших в сеть CHOP и использующих Wiki.CHOP из внешней сети, можно найти в документах «Общая информация» и «Инструкции».
Войдите на wiki.chop.edu
Почему Wiki.CHOP?
- Преодолеть групповые разрозненности : Открытая взаимосвязанная структура позволяет свободно обмениваться информацией между всеми сотрудниками организации.
- Превратите разговоры в действия : создан для получения устойчивых знаний, поэтому вы никогда не потеряете отличные идеи или контекст в кратковременном уведомлении или чате.
- Организуйте все в одном месте : От документов по квартальному планированию до блогов о новых сотрудниках — все живет в Confluence.
- Создайте культуру открытой командной работы : Благодаря социальным функциям сотрудники на всех уровнях имеют право голоса, чтобы вносить свой вклад, делиться информацией и получать отзывы.

- Сотрудничество с внешними коллегами : Делитесь документами и файлами с внешними соавторами. Начните процесс предоставления доступа к Wiki.CHOP соавторам с запроса на регистрацию нетрадиционного персонала.
- Безопасность корпоративного уровня : Wiki.CHOP — это Confluence, специально созданный для растущих команд, которым нужна безопасная и надежная база для совместной работы над критически важными проектами. С Confluence сайт вашей команды защищен проверенными в отрасли средствами безопасности, средствами контроля конфиденциальности, шифрованием данных и соблюдением нормативных требований. Масштабируйте свое предприятие с уверенностью.
Войдите в систему, чтобы просмотреть запись онлайн-семинара «RIS HITS — Wiki.CHOP.edu 2022», презентация администраторов Wiki.CHOP.edu и вспомогательного персонала.
Подробнее
Программа нетрадиционного персонала
Программа, предназначенная для набора нетрадиционного персонала, который будет участвовать в исследованиях в детских…
Подробнее
Запросить пространство Wiki.

 Эта нижняя, но самая разнообразная «ступень пирамиды» охватывает более десятка должностей. Выбор зависит от специфики деятельности ЧОП и его масштабов.
Эта нижняя, но самая разнообразная «ступень пирамиды» охватывает более десятка должностей. Выбор зависит от специфики деятельности ЧОП и его масштабов.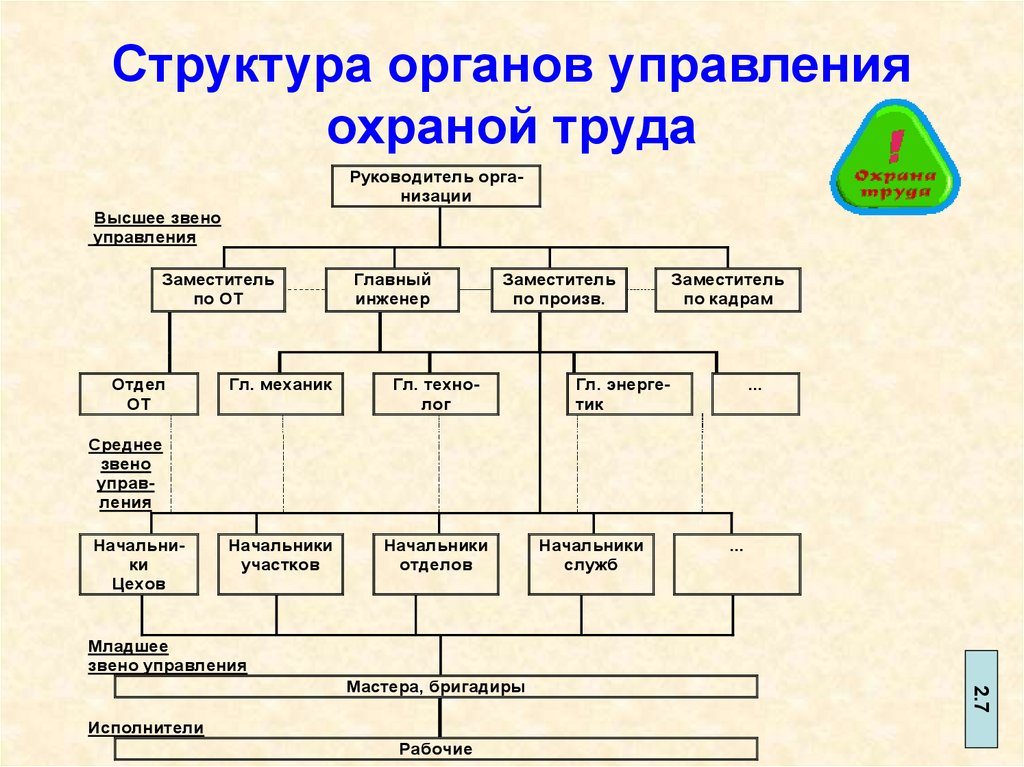 Выполните обязательные требования к образованию и найдите онлайн-обучение и профессиональное развитие под руководством инструктора, чтобы сделать следующий шаг в своей карьере в CHOP.
Выполните обязательные требования к образованию и найдите онлайн-обучение и профессиональное развитие под руководством инструктора, чтобы сделать следующий шаг в своей карьере в CHOP.